Wasser aufbereiten mit Ionenaustauschern
Ionenaustauscherharze in der Wasseraufbereitung

Wasser in technischen Anwendungen, z.B. Kesselspeisewasser, Heizungswasser oder Prozess- und Betriebswasser stammt üblicherweise aus dem öffentlichen Trinkwassernetz oder wird aus Brunnen, Flüssen und Seen gefördert.
In unserer industrialisierten Welt ist das Trinkwasser bereits umfangreichen Wasseraufbereitungsverfahren unterzogen worden, wird streng kontrolliert und wird als klare farblose Flüssigkeit, frei von störenden Gerüchen und schädlichen Bakterien oder Substanzen, jedoch angereichert mit lebenswichtigen Mineralien und Salzen geliefert.
Diese Wasserqualität besitzt Lebensmittelqualität kann aber für technische Anwendungsbereiche nicht unbedingt geeignet sein. Da Wasser aus mehr besteht, als aus reinen Wassermolekülen (H2O), können sich verschiedene gelöste und ungelöste Stoffe auf dessen Qualität und somit auf die Eignung des Wassers für den jeweiligen Anwendungsfall auswirken.
Je nach Herkunft kann Wasser mehr oder weniger gelöste und ungelöste Stoffe enthalten, welche ihm seine Eigenschaften geben. Die im Wasser vorkommenden Substanzen können sein:
Gelöste Stoffe im Wasser, die für das menschliche Auge nicht sichtbar sind:
- Elektrische Ladungsträger (Ionen): Calcium, Magnesium, Natrium, Carbonate, Chloride, Sulfate, Kieselsäure
- Gelöste Gase: Sauerstoff, freie Kohlensäure, Stickstoff
- Organische Stoffe: Huminsäuren, Zucker, Pflanzenschutzmittel, Medikamentenrückstände
Ungelöste Stoffe im Wasser, die sichtbar sein können:
- Anorganische Stoffe: Rostrückstände bzw. Oxide, Partikel und Schwebstoffe, Kolloide, Kieselsäure
- Organische Stoffe: Algen, Bakterien, Keime, Mikroorganismen
Der Ionenaustausch entfernt elektrische Ladungsträger (Ionen) aus dem Wasser
Mineralien, Salze und Kohlensäure lösen sich im Wasser als elektrische Ladungsträger, Ionen genannt. Sie geben dem Wasser Eigenschaften in Form von messbaren Größen, wie elektrische Leitfähigkeit, Gesamthärte und pH-Wert. Da die Löslichkeit dieser Stoffe wesentlich von der Menge, der Wassertemperatur und Anwendungsdrücken abhängt, haben die im Wasser gelösten Stoffe einen auschlaggebenden Einfluss auf dessen technische Nutzbarkeit.
Ein Wasser mit einer hohen Gesamthärte enthält beispielsweise eine größere Menge an gelösten Carbonaten in Form von Karbonathärte (Hydrogencarbonaten) von Calcium und Magnesium. Bei einer Temperaturerhöhung ändern sich Löslichkeitsverhältnisse, die vormals gelöste Kohlensäure (Hydrogencarbonat) wird freigesetzt und es können sichtbaren Kalkablagerungen bei technischen Anwendungen entstehen (Kesselstein). Diese auch als temporäre Härte bezeichnete Härte wird auch in kleinen Haushaltsfiltern entfernt, die in vielen Kaffeevollautomaten zum Einsatz kommen.
Mit dem Ionenaustausch kann Wasser gezielt aufbereitet werden. Die im Wasser gelösten elektrischen Ladungsträger werden entfernt bzw. ausgetauscht das Wasser wird so für den jeweiligen Anwendungszweck brauchbar gemacht.

Was sind Ionen?
Die Anwesenheit von Ionen in Wasser hängt mit der Eigenschaft des Wassers als Lösungsmittel zusammen. Die Löslichkeit eines Stoffes in Wasser setzt eine Wechselwirkung der Moleküle des Stoffes mit den Molekülen des Wassers voraus. Diese Wechselwirkung führt beim Lösungsvorgang des Stoffes in Wasser zu einer Spaltung der Ionenbindung und zum Entstehen völlig unabhängiger Ionen im Wasser.
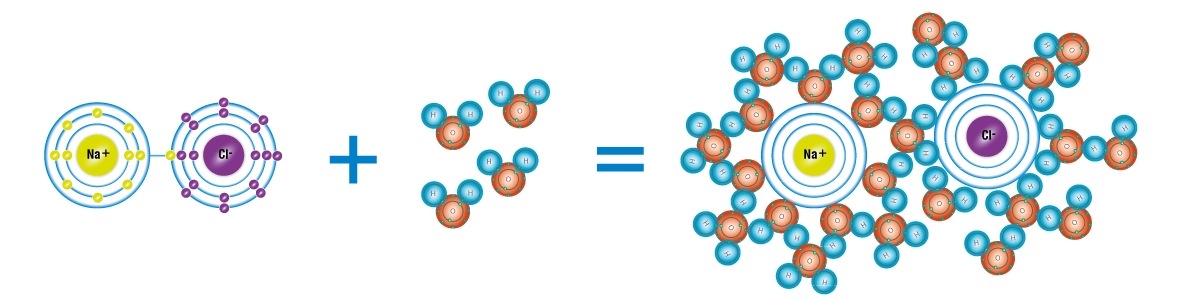
Am Beispiel von Kochsalz lässt sich der Lösungsvorgang von Stoffen in Wasser anschaulich erläutern.
Kochsalz liegt in kristalliner ungelöster Form als regelmäßiger Verbund der Atome Natrium und Chlor vor. Nach unserer Vorstellung sind Atome von Elektronen umgeben, die in Schalen um den Atomkern angeordnet sind. Atome versuchen stets einen energiegünstigen Zustand zu erreichen und ihre Schalen mit Elektronen zu sättigen. Daher gehen Atome mit anderen Atomen Verbindungen ein. Im Fall von Kochsalz bietet das Natriumatom ein überschüssiges Elektron und dem Chloratom fehlt eines. Bei der Verbindung von Natrium und Chlor kann der entsprechende Elektronenausgleich stattfinden und Natriumchlorid (Kochsalz) in kristalliner Form entstehen. Das Natrium gibt das überschüssige Elektron an das Chlor ab, wodurch der energiegünstige Zustand (Edelgaskonfiguration) erreicht ist.
Das Wassermolekül besteht ebenfalls aus Atomen – zwei Wasserstoffatomen und einem Sauerstoffatom. Wenn das kristalline Natriumchlorid in Kontakt mit einer ausreichenden Menge an Wassermolekülen kommt, drängen sich die Wassermoleküle zwischen die beiden Atome und lösen die Verbindung auf. Bei diesem Lösungsvorgang verbleibt das vormals überschüssige Elektron des Natriums bei dem Chloratom. Dadurch entstehen eine negative Überschussladung auf der Seite des Chlors und eine positive Ladung bei dem Natrium. Die kristalline Form geht verloren und beide Stoffe lösen sich als Ionen im Wasser. Natrium liegt danach als einfach positiv geladenes Ion (Kation) und Chlor als negativ geladenes Ion (Anion) vor. Die Bezeichung Anionen und Kationen leiten sich aus dem Verhalten der Ionen im Wasser ab. Wird eine Spannung zwischen zwei Elektroden angelegt, die ins Wasser tauchen, so wandern in diesem elektrischen Feld die Anionen zur Anode und die Kationen zur Kathode.
Die Wassermoleküle umringen nach diesem Vorgang die Ionen und richten, entsprechend der Ladung des Ions, ihre positiv geladenen Wasserstoffatome oder das negativ geladene Sauerstoffatom zu diesem aus. Um die Ionen herum entsteht eine Hydrathülle. Dieser Vorgang wird Dissoziation genannt.
Im Wasser lösen sich auf dem Weg zum Verbraucher eine Vielzahl an Mineralien, Gase und Salze. Deren Gesamtzahl bestimmt letztendlich den sogenannten Gesamtsalzgehalt im Wasser und aufgrund der spezifischen Salzeigenschaften die elektrische Leitfähigkeit des Wassers. Die gesamte Menge an Calcium- und Magnesiumionen hingegen bestimmt das Maß der Gesamthärte des Wassers.
Typischerweise finden sich folgende Ionen im Wasser:
| Kationen | Anionen |
|---|---|
| Na+ (Natrium) | HCO3- (Bicarbonat oder Hydrogencarbonat) |
| Ca2+ (Calcium) | Cl- (Chloride) |
| Mg2+ (Magnesium) | CO32- (Carbonat) |
| K+ (Kalium) | SO42- (Sulfat) |
| Fe2+ (Eisen) | NO3- (Nitrat) |
| Mn2+ (Mangan) | HSiO3- (Silikat) |
Wenn ionogen gelöste Stoffe das Wasser für den jeweiligen Anwendungszweck unbrauchbar machen, kann das Wasser durch gezielte Aufbereitung mit Ionenaustauschern nutzbar gemacht werden. Der Ionenaustausch entfernt alle ionogen gelösten Stoffe, Mineralien und Salze aus dem Wasser.
Der Ionenaustausch wird häufig zur Vollentsalzung von Wasser eingesetzt, was auch Demineralisierung oder Deionisation genannt wird. Neben der Vollentsalzung werden Ionenaustauscher auch zur Teilentsalzung (Entkarbonisierung) oder zum gezielten Austausch von Ionen, z.B. bei der Wasserenthärtung, oder zum selektiven Entfernen bzw. Absorbieren von Substanzen verwendet (Schwermetallentfernung, Chromatentfernung und Nitratentfernung).
Ionenaustauscher werden in vielen Industriebereichen eingesetzt
- Haushalt: In Haushalten werden Ionenaustauscher zur Enthärtung von Trinkwasser, zur Wasseraufbereitung in Spülmaschinen, in Trinkwasserfiltern (z.B. von BRITA), oder zur Aufbereitung von Heizungsfüllwasser verwendet.
- Energieversorgung: Die Energieversorgung benötigt hochreines Wasser als Speisewasser für Dampfkessel oder Nuklearreaktoren zur Vermeidung von Ablagerungen, Korrosion und Schäden durch Kalksteinbildung.
- Lebensmittelindustrie: Damit die Wasserzusammensetzung keinen Einfluss auf den finalen Geschmack eines industriell oder in Großküchen gefertigten Lebensmittels oder Getränkes nimmt, wird normalerweise mit vollentsalztem Wasser gearbeitet.
- Elektronikindustrie: Damit die Wasserzusammensetzung keinen Einfluss auf den finalen Geschmack eines industriell oder in Großküchen gefertigten Lebensmittels oder Getränkes nimmt, wird normalerweise mit vollentsalztem Wasser oder teilentsalztem Wasser gearbeitet.
- Kosmetikindustrie: Die Kosmetikindustrie nutzt vollentsalztes Wasser zum Ansetzen ihrer Rezepturen für Shampoos, Seifen, Cremen und Parfums.
- Chemische Industrie: Die chemische Industrie verwendet vollentsalztes Wasser für viele Anwendungszwecke, wie zum Waschen, Verdünnen, Lösungsmittel oder als Trägermaterial für andere Substanzen.
- Pharmazeutische Industrie: In der Pharmazeutischen Industrie wird vollentsalztes Wasser insbesondere zum Reinigen von Oberflächen, zum Verdünnen und Ansetzen von Lösungen und zur Produktion der Medikamente eingesetzt.
- Galvanikindustrie: In der Galvanik wird vollentsalztes Wasser in den Produktionsvorgängen eingesetzt. Hier wird der Ionenaustausch auch zur Reinigung von Abwässern sowie zur Rückgewinnung von Metallen verwendet.
- Keramikindustrie: Die Keramikindustrie nutzt vollentsalztes Wasser für die Reinigung von Tonstücken oder der Produktion von Emaille.
- Recycling und Rohstoffindustrie: In diesem Bereich wird Ionenaustausch zur Reinigung von Abwässern bzw. zur Rückgewinnung von Metallen genutzt.
- Textilindustrie: In der Textilindustrie wird in Fertigungsvorgängen mit Dampf gearbeitet und Räume müssen eine spezifische Feuchte aufweisen. Für diese Zwecke wird vollentsalztes Wasser eingesetzt.
- Logistikbranche: In der Logistikbranche wird vollentsalztes Wasser für Kühlsysteme, Batterien, zur Dampferzeugung, zur Reinigung und viele andere Zwecke verwendet.
- Halbleiterindustrie: In der Herstellung von Halbleitern werden höchste Ansprüche an die Wasserqualität gestellt. Geringste Verunreinigungen können zu Fehldotierungen führen und somit die Speicherdichte etc. reduzieren. So wird häufig auch Borsäure selektiv in Ultrareinstwasser (18,2 MOhm) entfernt.
Was sind Ionenaustauscherharze?
Die wesentliche Eigenschaft von Ionenaustauschern besteht darin, dass sie die in dem sie umgebenden Medium gelösten Ionen aufnehmen und gegen andere Ionen, die sich auf dem Ionenaustauscher befinden, austauschen. Dieser Vorgang ist reversibel.
Die heute in der technischen Industrie verwendeten Ionenaustauscher nehmen sich natürliche Ionenaustauschermaterialien, wie Zellulose oder Zeolith, als Vorbild und funktionieren nach einem ähnlichen Prinzip. Die modernen Ionenaustauscherharze sind typischerweise hoch funktionalisierte Polymere (Kunststoffe) mit unterschiedlichsten Eigenschaften.

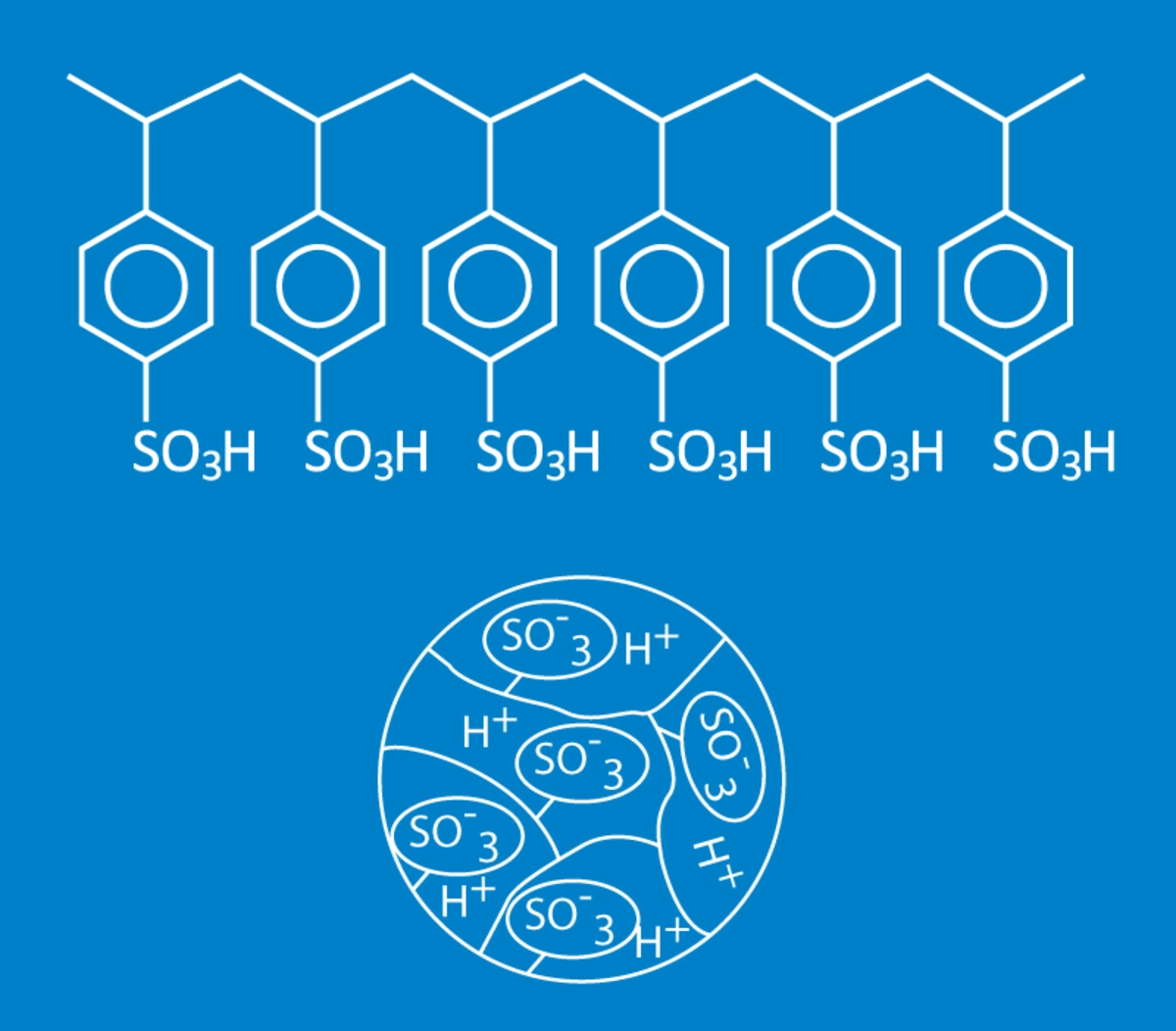
Auf dem Ionenaustauscherharz sind sogenannte funktionelle Gruppen (chemische Verbindungen) vorhanden, die Ionen mehr oder weniger stark an sich binden können. Man spricht hierbei von Selektivität.
So reagieren die funktionellen Gruppen auf dem Kationentauscherharz mit den im Wasser gelösten Kationen (positiv geladene Ionen), jedoch unterschiedlich stark bei verschiedenen Kationen. Enthält das Wasser beispielsweise Calcium- und Natriumionen, so wird das Kationentauscherharz bevorzugt Calciumionen aus dem Wasser aufnehmen und die Natriumionen werden von Calciumionen verdrängt. Dies ist der Grund, warum in einer Vollentsalzung die messbare Leitfähigkeit in aller Regel aus dem Natriumschlupf entsteht.
Ein klassisches stark saures Kationentauscherharz weist folgende Selektivitätsreihe auf:
Ba2+ (Bariumion) > Pb2+ (Bleiion) > Ca2+ (Calciumion) > Ni2+ (Nickelion) > Mg2+ (Magnesiumion) > K+ (Kaliumion) > NH4+ (Ammoniumion) > Na+ (Natriumion) > H+ (Wasserstoffion)
Ein stark basischer Anionenaustauscher reagiert mit den im Wasser gelösten Anionen (negativ geladene Ionen) und verfügt über die folgende Selektivitätsreihe:
SO42- (Sulfation) > HSO4- (Hydrogensulfation) > I- (Iodidionen) > NO3- (Nitration) > Br- (Bromion) > Cl-(Chloridion) > HCO3- (Hydrogencarbonation) > HSiO3- (Silikation) > F- (Fluoridion) > OH- (Hydroxidion)
Diese Selektivitätsunterschiede der Ionenaustauscher ermöglicht es, die Ionenaustauscherharze gezielt mit Ionen zu regenerieren. Setzt man beispielsweise ein Kationentauscherharz einer reinen Natriumchloridlösung aus, so wird sich das Kationentauscherharz mit den Natriumionen anreichern.
Kommt das dann mit Natrium regenerierte Kationentauscherharz mit Wasser in Kontakt, welches Calciumionen enthält, wird das Ionenaustauscherharz die Calciumionen aufnehmen und im Gegenzug Natriumionen abgeben.
Die Wasser Enthärtung mit Ionenaustauschern

Die Enthärtung von Wasser mit Ionenaustauschern gilt als Basisverfahren in der Ionenaustauschertechnologie. Nicht ohne Grund, denn die Wasserenthärtung war das erste industriell genutzte Ionenaustauscherverfahren zur Wasseraufbereitung, welches zunächst mit natürlichen Ionenaustauschermaterialien und später mit künstlich hergestellten Polymeren durchgeführt wurde.
Bei der Enthärtung von Wasser wird heutzutage im Normalfall sulfoniertes Polystyrol als stark saurer Kationentauscher in Natriumform eingesetzt.
Der stark saure Kationentauscher wird in einer Ionenaustauschersäule vorgehalten, die z.B. von oben nach unten mit Wasser durchströmt wird. Die in dem Wasser enthaltenen Härtebildner (Calcium und Magnesium) werden bei Kontakt mit dem Ionenaustauscher von diesem aufgenommen und gegen die auf dem Ionenaustauscher vorhandenen Natriumionen ausgetauscht.
Durch den Austausch der Calcium- und Magnesiumionen gegen Natriumionen enthält das Wasser keine härtebildenden Salze mehr und kann daher als vollständig enthärtetes Wasser (Weichwasser) bezeichnet werden.
Die Gesamthärte, welche vor dem Ionenaustausch in Form der Hydrogencarbonate von Calcium Ca(HCO3)2 und Magnesium Mg(HCO3)2 vorlag, ist nun als Natriumhyrogencarbonat NaHCO3 im Wasser vorhanden. Mögliche technische Probleme, welche mit der Bildung von Kalkstein einhergehen, sind dadurch ausgeschlossen.
Die Aufnahmekapazität des Ionenaustauschers richtet sich nach der Gesamthärte des Rohwassers und der Menge der Ionenaustauscherharze. Sobald alle Natriumionen gegen Calcium und Magnesiumionen ausgetauscht worden sind, ist der Ionenaustauscher erschöpft. Zur Kapazitätsbezeichnung des Kationentauschers wird wird häufig der Begriff Härteliter verwendet. Dies ist die Menge Wasser, die 1 Liter Harz oder ein Filter mit einer spezifischen Menge Harz bei einer Härte von 10°dH aufbereiten kann.
Aufgrund der vollständigen Umkehrbarkeit des Ionenaustauschervorganges kann die Enthärtungsanlage jedoch jederzeit wieder in einen betriebsbereiten Zustand zurückgeführt werden. Diesen Vorgang nennt man Regeneration.
Im Fall der Enthärtung durch Ionenaustauscher wird das Harzbett mit einer ca. 10%igen Natriumchloridlösung durchströmt. Da Ionenaustauscherharze stets ein chemisches Gleichgewicht anstreben (siehe Massenwirkungsgesetz) lassen die Harze die Calcium- und Magnesiumionen los und nehmen im Gegenzug Natriumionen auf. Nach dieser Regeneration befindet sich der Kationentauscher wieder in seinem Ursprungszustand. Da sich bei der Enthärtung der pH-Wert nicht ändert (ebenso bei der Nitratentfernung mit Anionenaustauschern) spricht man hier von einem Neutralaustausch.
Die Teilentsalzung von Wasser mit Ionenaustauschern

Die Teilentsalzung von Wasser wird üblicherweise zur Entkarbonisierung von Wasser eingesetzt. Von Entkarbonisierung wird gesprochen, wenn die mit Hydrogencarbonat assoziierten Calcium- und Magnesiumionen aus dem Wasser entfernt werden.
Wie bei der Enthärtung von Wasser sollen in nachfolgenden technischen Prozessen die Bildung von Ablagerungen (Kalkstein) verhindert werden.
Die Entkarbonisierung durch Teilentsalzung des Wassers mit Ionenaustauschern reduziert den Salzgehalt des Wassers. Eine Enthärtung durch den Austausch von Calcium- und Magnesium- mit Natriumionen hingegen stellt eine Umsalzung dar. Unter Umständen kann hierbei auch eine physiologische Wirkung durch den hohen Natriumgehalt folgen. Falls eine Änderung des Trinkwassers z.B. durch den Einbau einer Enthärtungsanlage erfolgt, ist dies immer den Verbrauchern mitzuteilen (Mitteilungspflicht).
In der Gastronomie ist die gängigste Anwendung die Teilentsalzung von Wasser für Kaffeemaschinen. Zum einen wird durch die Teilentsalzung die Bildung von Kalkstein verhindert, zum anderen kann dem Kaffee durch die salzarme Wasserqualität ein hervorragender Geschmack gegeben werden.
Bei der Teilentsalzung von Wasser kommt ein schwachsaurer Kationenaustauscher in H-Form zum Einsatz. H-Form bedeutet, dass der Kationentauscher mit Wasserstoffionen beladen ist.
Der schwachsaure Kationentauscher nimmt gezielt die Ionen auf, die an Kohlensäure gebunden sind. Im Gegenzug gibt der Kationentauscher Wasserstoffionen ab.
Im Resultat sinkt die Gesamthärte des Wassers, der Gesamtsalzgehalt wird reduziert und es entsteht freie Kohlensäure, wodurch das Wasser einen sauren Charakter erhält.
Der Vorgang der Teilentsalzung mit Ionenaustauschern ist ebenso reversibel, wie die Enthärtung mit Ionenaustauschern. Unter Einsatz von Salzsäure kann das schwachsaure Kationentauscherharz vollständig regeneriert werden.
Der selektive Ionenaustausch mit Ionenaustauschern

Mit sogenannten Selektivaustauschern können gezielt gelöste Ionen aus wässrigen Lösungen entfernt werden. Bei diesen Selektivaustauscherharzen handelt es sich um speziell produzierte und aufbereitete Ionenaustauscherharze, die auf den jeweiligen Anwendungszweck zugeschnitten sind.
Selektivtauscherharze werden beispielsweise in Galvaniken eingesetzt, um gelöste Schwermetallionen aus den Galvanikabwässern herauszufiltern oder um diese zurückzugewinnen. Durch den Einsatz der Selektivtauscherharze können beispielsweise Nickelionen aus dem Galvanikabwasser zurückgewonnen. Bei der Regeneration des Selektivtauscherharzes werden die Nickelionen wiederum von dem Harz entfernt, wodurch im Resultat eine konzentrierte Nickellösung entsteht.
Der Einsatz von Selektivtauschern ist vielfältig. Es können sowohl Anionen als auch Kationen selektiv ausgetauscht werden. Im Normalfall handelt es sich um Spezialanwendungen, die vor Einsatz des selektiven Ionenaustauschers im realen Prozess unter Laborbedingungen getestet und ausgewertet werden.
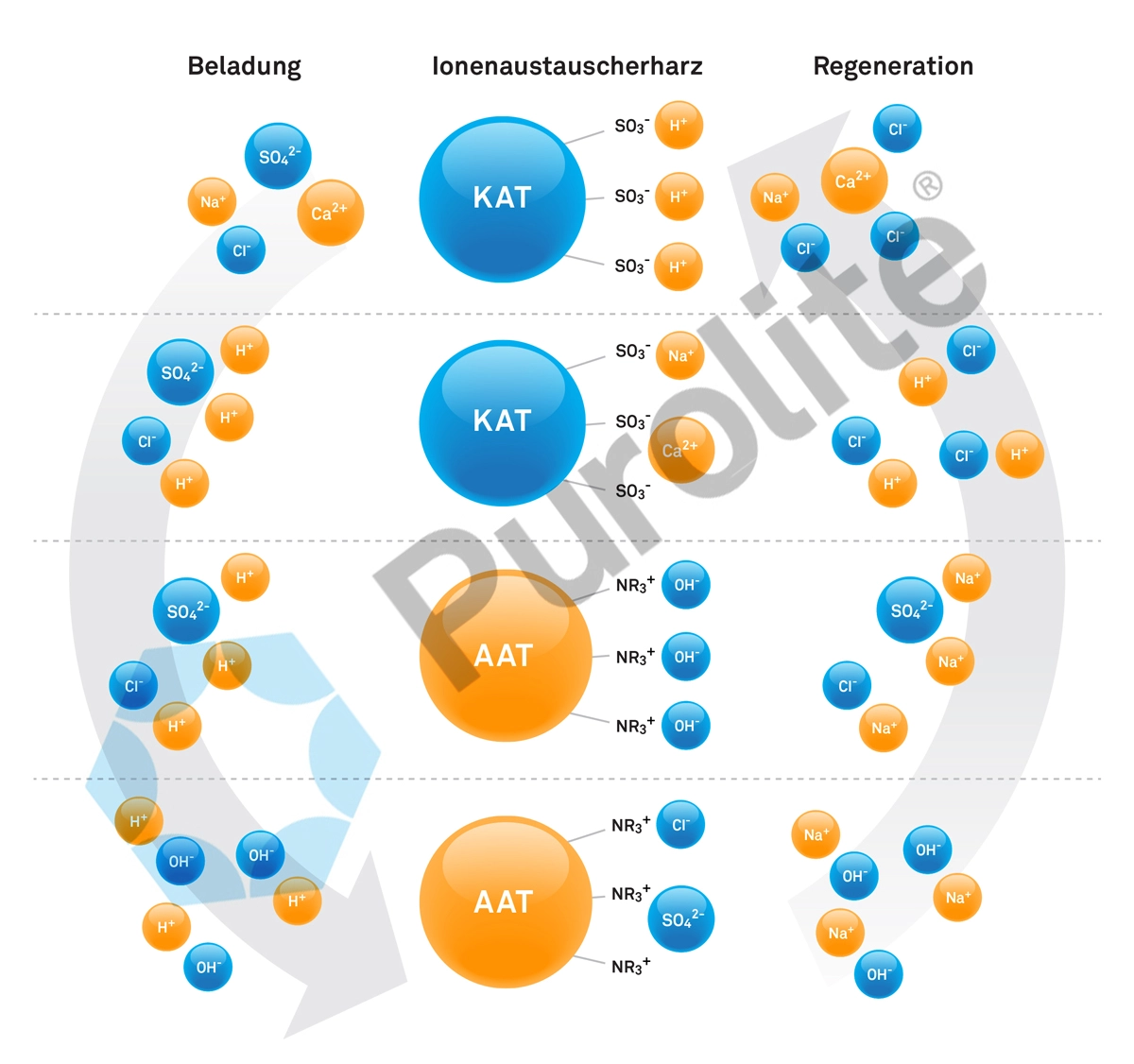
Die klassische Vollentsalzung von Wasser mit Ionenaustauschern

Die Vollentsalzung von Wasser mit Ionenaustauschern wird eingesetzt, um reines Wasser zu erzeugen. Bei der Vollentsalzung werden sämtliche im Wasser gelöste Salze schrittweise entfernt.
Zu diesem Zweck besteht eine Ionenaustauscheranlage zur Vollentsalzung aus mehreren Ionenaustauschersäulen, wobei diverse Konfigurationsmöglichkeiten von Ionenaustauscheranlagen denkbar sind.
In der ersten Säule befindet sich häufigein stark saurer Kationentauscher in H-Form, gefolgt von einer Entgasungsstufe (Riesler oder Membranentgasung), an die eine Ionenaustauschersäule mit einem stark basischen Anionentauscher in OH-Form anschließt.
In der ersten Ionenaustauschersäule werden alle im Wasser gelösten Kationen (positiv geladene Ionen) entfernt und gegen Wasserstoffionen (H+) ausgetauscht.
Durch diesen Austausch entsteht ein Wasser mit einem stark sauren Charakter, in welchem unter anderem auch freie Kohlensäure vorhanden ist.
Um den Anionentauscher nicht unnötig zu belasten wird das Wasser hinter dem Kationentauscher entgast, wodurch die freie Kohlensäure entfernt wird.
In dem dann folgenden Anionenaustauscher werden die restlichen im Wasser noch vorhandenen Anionen entfernt und gegen Hydroxidionen (OH-) ausgetauscht.
Das resultierende Wasser ist reines H2O, gängigerweise mit einem pH-Wert auf einem Niveau von 7,5 – 8,2 und einer elektrischen Leitfähigkeit von ~ <0,1-1 µS/cm.
Die Ionenaustauschersäulen werden separat voneinander regeneriert. Zur Regeneration des Kationentauschers kommt Salzsäure und zur Regeneration des Anionentauschers Natronlauge zum Einsatz.
Die Vollentsalzung von Wasser mit Ionenaustauscher Mischbettharzen

Die Vollentsalzung von Wasser kann auch mit sogenannten Ionenaustauscher Mischbettharzen durchgeführt werden.
Solche Ionenaustauscherharze bestehen aus einer definierten Mischung von starksauren Kationentauscherharzen und starkbasischen Anionetauscherharzen. Was in der klassischen Vollentsalzung über verschiedene Ionenaustauschersäulen abgebildet wird, zeigt sich bei dem Mischbettharz in Form der Ionenaustauscherkugeln. Eine Kationentauscherkugel und eine Anionentauscherkugel ergeben gemeinsam gemischt in dem Harzbett eine vollständig funktionelle Ionenaustauscheranlage. Bei einem Ionenaustauscher Mischbettharz handelt es sich demnach um eine Ansammlung von tausenden Ionenaustauscheranlagen.
Das Funktionsprinzip ist identisch zu der klassischen Vollentsalzung. Der Kationentauscher tauscht alle positiv geladenen Ionen gegen Wasserstoffionen und der Anionentauscher tauscht alle negativ geladenen Ionen gegen Hydroxidionen aus. Lediglich die Entgasungsstufe fehlt, wodurch der Anionenaustauscherauch die Kohlensäure aufnehmen muss.
Im Resultat entsteht sehr reines Wasser mit einer Leitfähigkeit <0,1 µS/cm. Ist ein Mischbettharz hinter einer Ionenaustauscheranlage zur Feinreinigung im Einsatz, so werden Leitfähigkeiten von 0,06-0,08 µS/cm erreicht.
Die Regeneration von Mischbettharzen ist möglich, jedoch aufwändiger, da das Mischbettharz vor der Regeneration getrennt werden muss. Ionenaustauscher-Mischbettharze werden zur Regeneration an Regenerierstationen gegeben oder als Einwegharze einmal verwendet und danach entsorgt.
Ionenaustauscher Mischbettharze werden üblicherweise in mobilen Filtersystemen, zum Beispiel bei der Aufbereitung von Heizungsfüllwasser, oder als sogenannte Polisherfilter eingesetzt.
Polisher werden benötigt, wenn vollentsalztes Wasser mit Hilfe von Umkehrosmoseanlagen erzeugt werden soll. Wasser, welches durch Umkehrosmose entsalzt wurde, weist je nach Betriebsweise und Qualität der Membran restliche gelöste Salze, wie Chloride oder Kohlensäure, auf. Zum Entfernen dieser Salze wird ein Ionenaustauscher mit Mischbettharz verwenden und so reines Wasser erzeugt.
Ionenaustauscher Mischbettharze erlauben eine kompakte Bauform von Ionenaustauscherfiltern und sind daher erste Wahl, wenn auf unkomplizierte Weise reines vollentsalztes Wasser erzeugt werden soll.
